Giáo án powerpoint còn gọi là bài giảng điện tử, giáo án điện tử, giáo án trình chiếu. Giáo án Powerpoint hóa học 7 Kết nối tri thức được Tài Liệu KHTN biên soạn dựa theo công văn mới nhất với nhiều phong cách khác nhau, hiện đại, tinh tế và đẹp mắt tạo sự thích thú cho học sinh.
MỘT SỐ TÀI LIỆU QUAN TÂM KHÁC
Click vào ảnh dưới đây để xem giáo án rõ
XEM VIDEO VỀ MẪU POWERPOINT GIÁO ÁN HÓA HỌC 7 SÁCH KẾT NỐI TRI THỨC
Chủ đề 1: NGUYÊN TỬ – SƠ LƯỢC BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ
BÀI 2: NGUYÊN TỬ
Môn học: Khoa học tự nhiên lớp 6
Thời gian thực hiện: 04 tiết
MỤC TIÊU
Về kiến thức
– Trình bày được mô hình nguyên tử Rutherford-Bohr (mô hình sắp xếp electrom các lớp ectron ở vỏ nguyên tử)
– Nêu được khối lượng của nguyên tử theo đơn vị quốc tế amu (đơn vị khối lượng nguyên tử)
Về năng lực
a) Năng lực chung
– Tự chủ và tự học: Chủ động, tự tìm hiểu vể nguyên tử, cấu tạo nguyên tử và giải thích tính trung hòa về điện của nguyên tử;
– Giao tiếp và hợp tác:
+ Sử dụng ngôn ngữ khoa học để diễn đạt về nguyên tử, các hạt tạo thành nguyên tử (proton, electron, neutron)
+ Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV trong khi thảo luận về nguyên liệu, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo;
– Giải quyết vấn đề và sáng tạo: Giải quyết vấn đề kịp thời với các thành viên trong nhóm để thảo luận hiệu quả, giải quyết các vấn đề trong bài học và hoàn thành các nhiệm vụ học tập.
b) Năng lực khoa học tự nhiên
– Nhận thức khoa học tự nhiên: Trình bày được mô hình nguyên tử Rutherford – Bohr (mô hình sắp xếp electron các lớp ectron ở vỏ nguyên tử); Nêu được khối lượng của một nguyên tử theo đơn vị quốc tế amu (đơn vị khối lượng nguyên tử)
– Tìm hiểu tự nhiên: Quan sát các hình ảnh về nguyên tử, mô hình nguyên tử Ruther ford – Bohr để tìm hiểu cấu trúc đơn giản về nguyên tử được học trong bài.
– Vận dụng kiến thức, kĩ năng đã học: Giải thích được nguyên tử trung hòa về điện, sử dụng mô hình nguyên tử Rutherford – Bohr để xác định các loại hạt tạo thành của một số nguyên tử học trong bài; Tính được khối lượng nguyên tử theo đơn vị amu dựa vào số lượng các hạt cơ bản trong nguyên tử.
Về phẩm chất
– Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
– Cẩn thận, trung thực và thực hiện các yêu cầu trong chủ để bài học.
– Có niềm say mê, hứng thú với việc khám phá và học tập khoa học tự nhiên.
THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
– Mô hình nguyên tử Carbon, nitrogen, oxygen
– Bìa carton, giấy màu vàng, các viên bi nhựa màu đỏ, xanh
– Các hình ảnh theo sách giáo khoa;
– Máy chiếu, bảng nhóm;
– Phiếu học tập.
Phiếu học tập 1Câu 1: Quan sát các mô hình nguyên tử đã chuẩn bị, thảo luận nhóm, hoàn thành bảng theo mẫu sau và trả lời câu hỏi:
Câu 2: Quan sát Hình 2.6 và cho biết Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… Số electron trên từng lớp ở vỏ nguyên tử chlorine ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….……………………………………………………………………………………………………………………………. |
Phiếu học tập 2Câu 1: Cho hình vẽ mô phỏng một nguyên tử Carbon sau:Hãy hoàn thiện bảng sau bằng cách viết tên, điện tích và khối lượng của các hạt tạo nên nguyên tử vào ô tưởng ưng.
Câu 2: Thành phần các nguyên tố trên mặt trời chủ yếu là hai nguyên tố hóa học hydrogen (H) và helium (He). Hình vẽ sau đây biểu diễn các nguyên tử của 2 nguyên tố H, He. Tâm của mỗi nguyên tử là gì? Phân tử B. Hạt nhân C. Vỏ electron D. Proton Mỗi vòng tròn xung quanh hạt nhân được gọi là gì? Một liên kết B. Một electron C. Một lớp electron D. Một proton Có bao nhiêu electron trong vỏ của nguyên tử H, He? Có bao nhiêu proton trong hạt nhân của nguyên tử H, He? |
III. TIẾN TRÌNH DẠY HỌC
PHƯƠNG PHÁP VÀ KĨ THUẬT DẠY HỌC
– Dạy học theo nhóm, nhóm cặp đôi.
– Kĩ thuật sơ đồ tư duy.
– Kĩ thuật sử dụng phương tiện trực quan.
– Dạy học nêu và giải quyết vấn đề thông qua câu hỏi trong SGK.
KHỞI ĐỘNG BÀI HỌC
Hoạt động 1: Quan sát mẫu chất – trả lời câu hỏi
a) Mục tiêu: Tạo được hứng thú cho học sinh, dẫn dắt giới thiệu vấn đề, để học sinh biết được chất được tạo từ đâu
b) Nội dung: HS cho học sinh coi clip giới thiệu thành phần cấu tạo nên chất. Tìm hiểu thành phần cấu tạo nên những chất này và tìm hiểu chất này được tạo từ đâu?
c) Sản phẩm: Học sinh bước đầu nói lên suy nghĩ của bản thân và có hướng điều chỉnh đúng trong nghiên cứu vấn đề.
d) Tổ chức thực hiện:
| Hoạt động của GV | Hoạt động của HS |
| Mọi vật thế tự nhiên hay nhân tạo đều được tạo thành từ mật số loại hạt vô cùng nhỏ bé gọi là nguyên tử. Vậy nguyên tử có cấu tạo như thế nào? | Học sinh coi clip và trả lời các câu hỏi của giáo viên đưa ra. |
| Giao nhiệm vụ: Hs thảo luận nhóm hoàn thành câu hỏi giáo viên đưa ra | Nhận nhiệm vụ |
| Hướng dẫn HS thực hiện nhiệm vụQuan sát, hỗ trợ HS khi cần thiết. | Thực hiện nhiệm vụ |
| Chốt lại và đặt vấn đề vào bài |
HÌNH THÀNH KIẾN THỨC MỚI
Hoạt động 1: Quan điểm ban đầu về nguyên tử
Mục tiêu: học sinh nắm được khái niệm ban đầu về nguyên tử
Nội dung: Giáo viên tổ chức cho học sinh hoạt động cặp đôi để làm rõ quan điểm nguyên tử của Đê-mô-crit và Đan tơn.
Sản phẩm: đáp án câu trả lời của HS
d) Tổ chức thực hiện
| Hoạt động của GV | Hoạt động của HS |
| Giao nhiệm vụ: – GV yêu cầu học hoạt động cặp đôi, xem clip giới thiệu học thuyết nguyên tử của Đê-mô-crit và Đan tơn kết hợp với thông tin SGK học sinh trả lời câu hỏi:Theo Đê – mô – crit và Đan – tơn, nguyên tử được quan niệm như thế nào?– Đi đến kết luận về quan điểm nguyên tử của Đê-mô-crit và Đan tơn.– Yêu cầu học sinh chốt lại kết luận | HS nhận nhiệm vụ. |
| Hướng dẫn HS thực hiện nhiệm vụ– Chọn một cặp đôi lên bảng trình bày– Mời nhóm khác nhận xét– Giáo viên nhận xét sau khi các nhóm đã có ý kiến bổ sung | Hoạt động cặp đôi hoàn thành nhiệm vụ |
| Tổng kết: – Đê – mô – crit quan niệm nguyên tử là những hạt vô cùng nhỏ, không thể phân chia nhỏ hơn được nữa, tạo nên các vật. Đan – tơn quan niệm tất cả các chất đều được cấu tạo nên từ nguyên tử. Nguyên tử là những hạt nhỏ nhất của vật chất, chúng không thể phân chia thành các hạt nhỏ hơn. | Ghi kết luận vào vở |
Hoạt động 2: Khái quát về mô hình nguyên tử
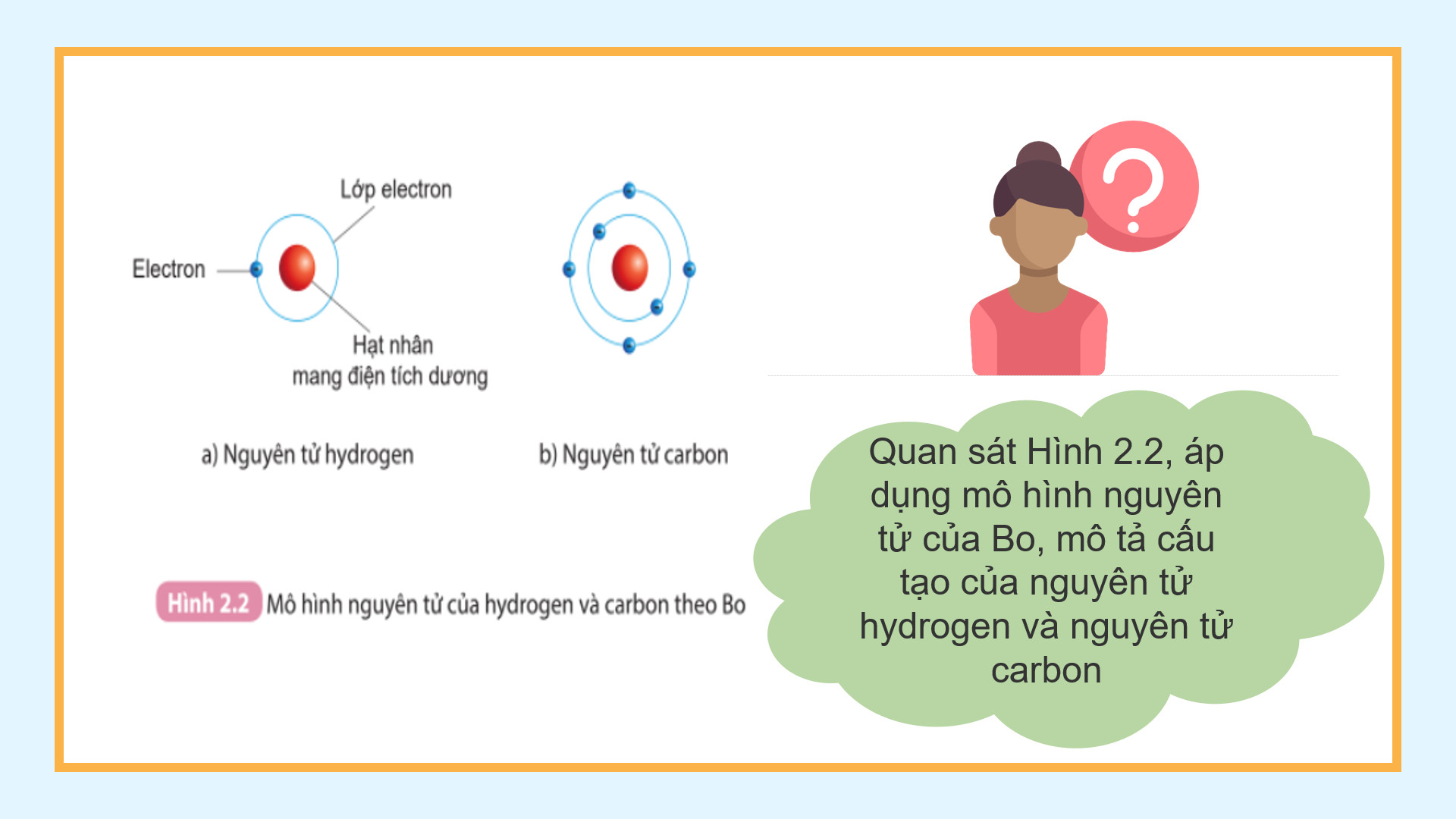
Mục tiêu: Giúp học sinh quan sát hình 2.1, 2.2 sgk trình bày được mô hình nguyên tử của Rutherford – Bohr
Nội dung: Tổ chức cho học sinh làm mô hình nguyên tử theo Bo. Thảo luận trả lời các câu hỏi SGK
Sản phẩm:
1. Các đường tròn bảng giấy màu vàng biểu diễn các lớp electron
2.Số electron có trong lớp electron thứ nhất và thứ hai của nguyên tử carbon lần lượt là 2,4 và lớp thứ nhất chứa tối đa electron.
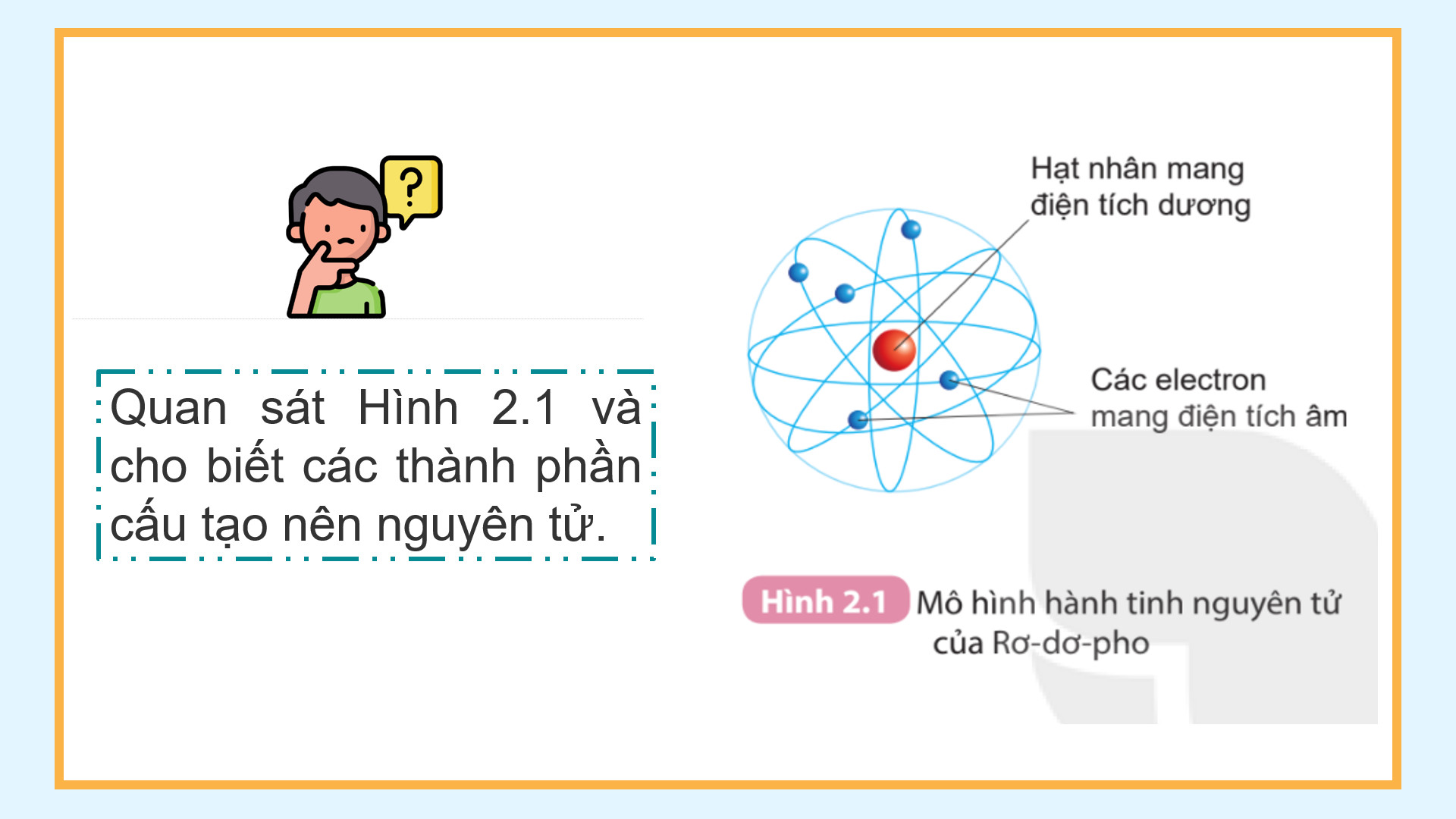
3. Hình 2.1 cho biết các thành phần cấu tạo nên nguyên tử gồm: Hạt nhân ở tâm nguyên tử và các electron chuyển động xung quanh hạt nhân nguyên tử.
4.Theo mô hình nguyên tử của Bo, cấu tạo của nguyên tử hydrogen gồm hạt nhân ở tâm nguyên tử và một electron ở lớp electron thứ nhất của nguyên tử. Nguyên tử carbon có hạt nhân ở tâm và hai lớp electron: lớp thứ nhất có 2 electron và lớp thứ 2 có 4 electron.
d) Tổ chức thực hiện:
| Hoạt động của GV | Hoạt động của HS |
| – Giáo viên giới thiệu mô hình nguyên tử Carbon, hướng dẫn cách tiến hành.– Chuẩn bị: bìa carton, giáy màu vàng, các viên bi nhựa to màu đỏ và các viên bi nhò màu xanh.– Cách tiến hành+ Gắn viên bi đỏ vào bìa carton làm hạt nhân nguyên từ carbo+ Cắt giấy màu vàng thành hai đường tròn có bán kính khác nhau và mỗi vòng tròn có độ dày khoảng 1 cm (Hình 2.3). Dãn các đường tròn lên bìa carton sao cho tâm của hai đường tròn là viên bi đỏ. Gắn các viên bi màu xanh lén hai đường tròn màu vàng như Hình 2. | |
| Giao nhiệm vụ: – Giáo viên chia học sinh 4 nhóm làm mô hình nguyên tử theo Bo. Thảo luận trả lời các câu hỏi SGK– Tổ chức cho học sinh làm việc nhóm làm mô hình nguyên tử carbon theo Bo và trả lời câu hỏi”
1. Các đường tròn bảng giấy màu vàng biểu diễn gì? 2. Em hãy cho biết số electron có trong lớp electron thứ nhất và thứ hai của nguyên tử carbon và chỉ ra lớp electron đã chứa tối đa electron. 3. Quan sát Hình 2.1 và cho biết các thành phần cấu tạo nên nguyên tử. 4. Quan sát Hình 2.2, áp dụng mô hình nguyên tử của Bo, mô tả cấu tạo của nguyên tử hydrogen và nguyên tử carbon. – Giáo viên cho học sinh video mô hình nguyên tử |
HS nhận nhiệm vụ. |
| Hướng dẫn HS thực hiện nhiệm vụ: GV quan sát, hỗ trợ các nhóm khi cần thiết. | Phân công nhiệm vụ và tiến hành thực hiện nhiệm vụ. |
| Báo cáo kết quả: – Mời các nhóm lên trình bày– Các nhóm còn lại đưa ra câu hỏi thắc mắc cho nhóm trình bày | – Các nhóm lần lượt trình bày sản phẩm– Nhóm khác nhận xét, bổ sung phần trình bày của nhóm bạn |
| Tổng kết: – Mô hình Rutherford – Bohr: Trong nguyên tử, các electron ở vỏ được sắp xếp thành từng lớp và chuyển động xung quanh hạt nhân theo những quỹ đạo như các hành tinh quay quanh Mặt trời– Nguyên tử là hạt vô cùng nhỏ, trung hoà về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm. | HS tìm hiểu sau khi học xong bài học. |
Hoạt động 3: Tìm hiểu cấu tạo nguyên tử
Mục tiêu: Giúp hiểu và vận dụng được mô hình nguyên tử của Rutherford – Bohr
Nội dung: Tổ chức cho học sinh tìm hiểu cấu tạo nguyên tử, cấu tạo hạt nhân, cấu tạo vỏ nguyên tử. Thảo luận trả lời các câu hỏi SGK
Sản phẩm:
Hạt nhân nguyên tử có nhiều hạt. Các hạt thuộc hai loại hạt khác nhau là proton và neutron
2 Số đơn vị diện tích hạt nhân của helium bằng +2
Phiếu học tập 1Câu 1:
Câu 2: Quan sát Hình 2.6 và cho biết– Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine: lần lượt từ lớp trong cùng, gần hạt nhân nhất ra phía ngoài xa hạt nhân hơn. Lớp electron thứ nhất có 2 e electron, lớp electrom thứ 2 có 8e và lớp electron ngoiaf cùng có 7e |
d) Tổ chức thực hiện:
| Hoạt động của GV | Hoạt động của HS | ||||||||||||||||||||
Giao nhiệm vụ: – Giáo viên cho học sinh xem video và trả lời câu hỏi:Theo Rutherford – Bohr, nguyên tử có cấu tạo như thế nào?– GV tổ chức cho học sinh tham gia trò chơi “Ai nhanh hơn” Giáo viên chuẩn bị 4 bộ thẻ hình, nội dung cho các nhóm ghép, đội nhanh hơn sẽ giành được chiến thắng’
– Giáo viên cho học sinh thảo luận cặp đôi quan sát hình 2.4 SGK mô hình của nguyên tử helium và trả lời câu hỏi: Hạt nhân nguyên tử cỏ một hay nhiều hạt? Các hạt đó thuộc cùng một loại hạt hay nhiều loại hạt? 2. Số đơn vị diện tích hạt nhân của helium bằng bao nhiêu?– Tổ chức cho học sinh làm việc nhóm và trả lời câu hỏi trong Phiếu học tập số 1– Giáo viên cho học sinh video cấu tạo một số nguyên tử |
HS nhận nhiệm vụ. | ||||||||||||||||||||
| Hướng dẫn HS thực hiện nhiệm vụ: – GV quan sát, hỗ trợ các nhóm khi cần thiết. | Phân công nhiệm vụ và tiến hành thực hiện nhiệm vụ. | ||||||||||||||||||||
| Báo cáo kết quả: – Mời các nhóm lên trình bày– Các nhóm còn lại đưa ra câu hỏi thắc mắc cho nhóm trình bày | – Các nhóm lần lượt trình bày sản phẩm– Nhóm khác nhận xét, bổ sung phần trình bày của nhóm bạn | ||||||||||||||||||||
| Đánh giá : Yêu cầu học sinh chấm điểm cho các nhómGiáo viên thu phiếu học tập để kiểm tra xem các nhóm chấm đúng hay không và lấy điểm cho học sinh | Các nhóm chấm điểm cho nhóm bạn. Báo cáo điểm cho nhóm bạn | ||||||||||||||||||||
| Tổng kết: – Vỏ nguyên tử gồm các hạt electron mang điện tích âm sắp xếp thành từng lớp.– Hạt nhân nguyên tử gồm các hạt proton mang điện tích dương và neutron không mang điện. | HS tìm hiểu sau khi học xong bài học. |
Hoạt động 5: Tìm hiểu khối lượng nguyên tử
Mục tiêu: Học sinh hiểu được khối lượng nguyên tử tập trung hầu hết ở Hạt nhân và vận dụng để tính được khối lượng của một nguyên tử khi bít số hạt proton và neutron trong hạt nhân của nó.
b) Nội dung: GV cho học coi video tìm hiểu về khối lượng của nguyên tử, đọc sách giáo khoa tìm hiểu và trả lời các câu hỏi trong sgk, rút ra kết luận: Khối lượng nguyên tử là khối lượng của một nguyên tử, được tính theo đơn vị quốc tế amu.
c) Sản phẩm: Sản phẩm học sinh
Em hãy cho biết vì sao khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử.
– Ta có:
+ Khối lượng 1 proton = 1 neutron = 1amu
+ Khối lượng 1 electron = 0,00055 amu
⇒ Khối lượng electron nhỏ hơn rất nhiều so với khối lượng proton và neutron
⇒ Có thể bỏ qua khối lượng của electron hay khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử
Proton và neutron có cùng khối lượng (gần bằng 1amu), còn electron có khối lượng rất bé (chỉ bằng khoảng 0,00055 amu), nhỏ hơn rất nhiều lần so với khối lượng của proton và neutron. Do đó, ta có thể xem khối lượng của hạt nhân là khối lượng của nguyên tử.
Hãy so sánh khối lượng của nguyên tử nhôm (13p, 14n) và nguyên tử đồng (29p, 36n).
– Ở câu hỏi 1 ta biết rằng khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử
– Khối lượng hạt nhân nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt nhân
– Mà: Khối lượng 1 proton = 1 neutron = 1amu
⇒ Khối lượng nguyên tử nhôm (13p, 14n)
= 13.1 + 14.1 = 27 amu
Khối lượng nguyên tử đồng (29p, 36n)
= 29.1 + 36.1 = 65 amu
⇒ Khối lượng nguyên tử nhôm/Khối lượng nguyên tử đồng = 27/65 ≈0,415
d) Tổ chức thực hiện
| Hoạt động của GV | Hoạt động của HS |
| Giao nhiệm vụ: – GV cho học sinh xem video giới thiệu về khối lượng phân tử– Giáo viên giới thiệu đơn vị amu, đặt vấn đề: 1. Em hãy cho biết vì sao khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử.2.Vì sao người ta thường sử dụng amu làm đơn vị khối lượng nguyên tử? – GV Cho học sinh quan sát hình sau và so sánh khối nguyên tử H và C dựa vào số hạt proton của nguyên tử đó– Chia lớp học làm 4 nhóm thảo luận
Hãy so sánh khối lượng của nguyên tử nhôm (13p, 14n) và nguyên tử đồng (29p, 36n). |
HS nhận nhiệm vụ. |
| Hướng dẫn HS thực hiện nhiệm vụ– Học sinh nghiên cứu sgk trả lời câu hỏi– Sau khi thảo luận xong, nhóm rút ra kết luận | Thảo luận nhóm, hoàn thành các câu hỏi |
| Báo cáo kết quả: – Cho các nhóm treo kết quả của nhóm mình lên ;– Mời nhóm trưởng đứng vào phần kết quả của nhóm mình;– Gọi 1 nhóm đại diện trình bày kết quả. Các nhóm khác bổ sung– GV kết luận về nội dung kiến thức mà các nhóm đã đưa ra. | – Nhóm xung phong trình bày kết quả – Nhóm khác nhận xét phần trình bày của nhóm bạn. |
| Tổng kếtKhối lượng nguyên tử tập trung ở hạt nhân, được coi bằng khối lượng của hạt nhân và có đơn vị là amu. | Ghi nhớ kiến thức |
Hoạt động 6: Luyện tập
Mục tiêu: Củng cố nội dung toàn bộ bài học
b) Nội dung: GV cho học sinh làm việc cá nhân và trả lời một số câu hỏi trắc nghiệm. Thảo luận nhóm hòa thành phiếu học tập số 2
c) Sản phẩm: Sản phẩm đáp án câu trả lời
Phiếu học tập 2Câu 1:
Câu 2: Tâm của mỗi nguyên tử là gì? Phân tử B. Hạt nhân C. Vỏ electron D. Proton Mỗi vòng tròn xung quanh hạt nhân được gọi là gì? Một liên kết B. Một electron C. Một lớp electron D. Một proton electron trong vỏ của nguyên tử H, He luần lượt 1, 2 electron. Trong proton hạt nhân của nguyên tử H, He có uần lượt 1, 2 proton |
d) Tổ chức thực hiện
| Hoạt động của GV | Hoạt động của HS |
| Giao nhiệm vụ: – GV trình chiếu câu hỏi, học sinh sử dụng bảng A,B,C,D để trả lờiCâu 1: Chọn đáp án đúng nhất
Trong nguyên tử Số p = số e Hạt nhân tạo bởi proton và electron Electron không chuyển động quanh hạt nhân Eletron sắp xếp thành từng lớp Câu 2: Chọn đáp án sai Khối lượng của hạt nhân được coi là khối lượng của nguyên tử Trong nguyên tử Số p = số e Hạt nhân tạo bởi proton và neutron Trong nguyên tử Oxygen có số p khác số e Câu 3: Đường kính của nguyên tử là 10-8 m 10-9 m 10-8 cm 10-9 cm Câu 4: Nguyên tử có khả năng liên kết với nhau. Tại sao? Chọn đáp án đúng Do có electron Do có neutron Tự đưng có sẵn Do khối lượng hạt nhân bằng khối lượng nguyên tử Câu 5: Trong khoảng không gian giữa hạt nhân và lớp vỏ electron của nguyên tử có những gì? Electron Neutron Proton Không có g Câu 6: Trong nguyên tử hạt nào mang điện tích dương? Electron Neutron Proton Electron và Proton Electron và ProtonCâu 7: Hạt nhân được cấu tạo bởi: Neutron và electron Proton và electron Proton và neutron Electron Câu 8: Nguyên tố carbon (C) là tập hợp những nguyên tố có cùng6 hạt nhân12 hạt proton12 hạt electron6 hạt protonCâu 9: Nguyên tử nguyên tố Y có tổng số hạt proton, neutron, electron là 52. Trong hạt nhân nguyên tử X có số hạt không mang điện nhiều hơn số hạt mang điện là 1. Xác định số proton X. 16 B. 17 C. 18 D.19 Câu 10: Tổng số hạt trong nguyên tử X là 40, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Tính số hạt electron trong nguyên tử X. 10 B. 13 C. 14 D.15 GV cho học sinh thảo luận nhóm và hoàn thành PHT số 2 |
HS nhận nhiệm vụ. |
| HS thực hiện nhiệm vụ | Học sinh trả lời câu hỏi |
| Báo cáo kết quả: – Cho cả lớp trả lời ;– Mời đại diện giải thích;– GV kết luận về nội dung kiến thức. | – |
| Tổng kếtKhối lượng nguyên tử là khối lượng của một nguyên tử, được tính theo đơn vị quốc tế amu. | Ghi nhớ kiến thức |
Hoạt động 7: Vận dụng
Mục tiêu: tổ chức hoạt động trải nghiệm với STEM làm mô hình nguyên tử
Nội dung: Học sinh dùng các vật liệu có chẵn tạo mô hình hình nguyên tử
Sản phẩm: mô hình nguyên tử
Tổ chức thực hiện
| Hoạt động của giáo viên | Hoạt động của học sinh |
| Giao nhiệm vụ: chia lớp làm 4 nhóm, mốc thăm tên nguyên tử, học sinh tìm hiểu học sinh lựa chọn phương pháp làm mô hình nguyên tử 3D | Giao nhiệm vụ |
| Hướng dẫn thực hiện nhiệm vụ: Thực hiện tại nhà giáo viên đửa ra hướng dẫn cần thiết | Thực hiện nhiệm vụ ở nhà |
| Báo cáo kết quả: Tiết sau nạp nộp mô hình nguyên tử cho cho giáo viên |
DẶN DÒ
Học sinh học bài và làm bài tập về nhà
Câu 1: Theo Rutherford – Bohr, nguyên tử có cấu tạo như thế nào?
Câu 2: Em hãy điền vào chỗ trống các từ, cụm từ thích hợp sau để được câu hoàn chỉnh:
Nguyên tử là hạt (1)………………… và (2)………………………… Theo Rutherford – Bohr, nguyên tử có cấu tạo gồm 2 phần là (3)………….. (mang (4)………………………) và (5)………………….. tạo bởi (6)……………. (mang (7)………………..).
Trong nguyên tử, các electron (8)………………… xung quanh hạt nhân và (9)………………. thành từng lớp.
Câu 3: Quan sát hình sau, hãy cho biết nguyên tử nitrogen và potassium có bao nhiêu:
Điện tích hạt nhân nguyên tử?
b) Lớp electron?
c) Electron trên mỗi lớp?
| Nguyên tử nitroge | Nguyên tử Potassium |
Câu 4: Cho biết các thành phần cấu tạo nên nguyên tử trong hình minh hoạ
Câu 5: Quan sát hình 2.6, hãy hoàn thành bảng
| Số đơn vị điện tích hạt nhân | Số Proton | Số electron trong nguyên tử | Số electron lớp ngoài cùng |
Câu 6: Quan sát mô hình dưới đây, cho biết số proton, số electron và xác định khối lượng nguyên tủ magnesium (biết số neutron bằng 12).
Mô hình nguyên tử magnesium (Mg)