Giáo án powerpoint Hóa học 10 Chân trời sáng tạo còn gọi là bài giảng điện tử, giáo án điện tử, giáo án trình chiếu. Giáo án Hóa học 10 Chân trời sáng tạo bản powerpoint được Tài Liệu KHTN biên soạn dựa theo công văn mới nhất với nhiều phong cách khác nhau, hiện đại, tinh tế và đẹp mắt tạo sự thích thú cho học sinh.
MỘT SỐ TÀI LIỆU QUAN TÂM KHÁC
Click vào ảnh dưới đây để xem giáo án rõ
XEM VIDEO VỀ MẪU POWERPOINT GIÁO ÁN HÓA HỌC 10 SÁCH CHÂN TRỜI SÁNG TẠO
KẾ HOẠCH BÀI DẠY
Chương 3: LIÊN KẾT HÓA HỌC
Bài 8: Quy tắc Octet
Môn học/Hoạt động giáo dục: Hóa học. Lớp: 10.
Thời gian thực hiện: …tiết
Mục tiêu bài học
Năng lực
1.1. Năng lực chung
– Năng lực tự chủ tự học: HS nghiêm túc thực hiện nhiệm vụ, trả lời câu hỏi tìm hiểu về quy luật để các nguyên tử trở nên bền vững khi chúng liên kết hóa học với nhau tạo thành phân tử. (1)
– Năng lực giải quyết vấn đề và sáng tạo: Từ kiến thức đã học HS vận dụng giải quyết các hiện tượng trong tự nhiên và giải quyết các câu hỏi bài tập. (2)
– Năng lực giao tiếp và hợp tác: Biết chủ động giao tiếp khi có vấn đề thắc mắc. Thông qua làm việc nhóm nâng cao khả năng trình bày ý kiến của bản thân, tự tin thuyết trình trước đám đông. (3)
1.2. Năng lực Hóa học
– Năng lực nhận thức kiến thức hóa học:
+ HS trình bày được quy tắc octet với các nguyên tố nhóm A. (4)
– Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học
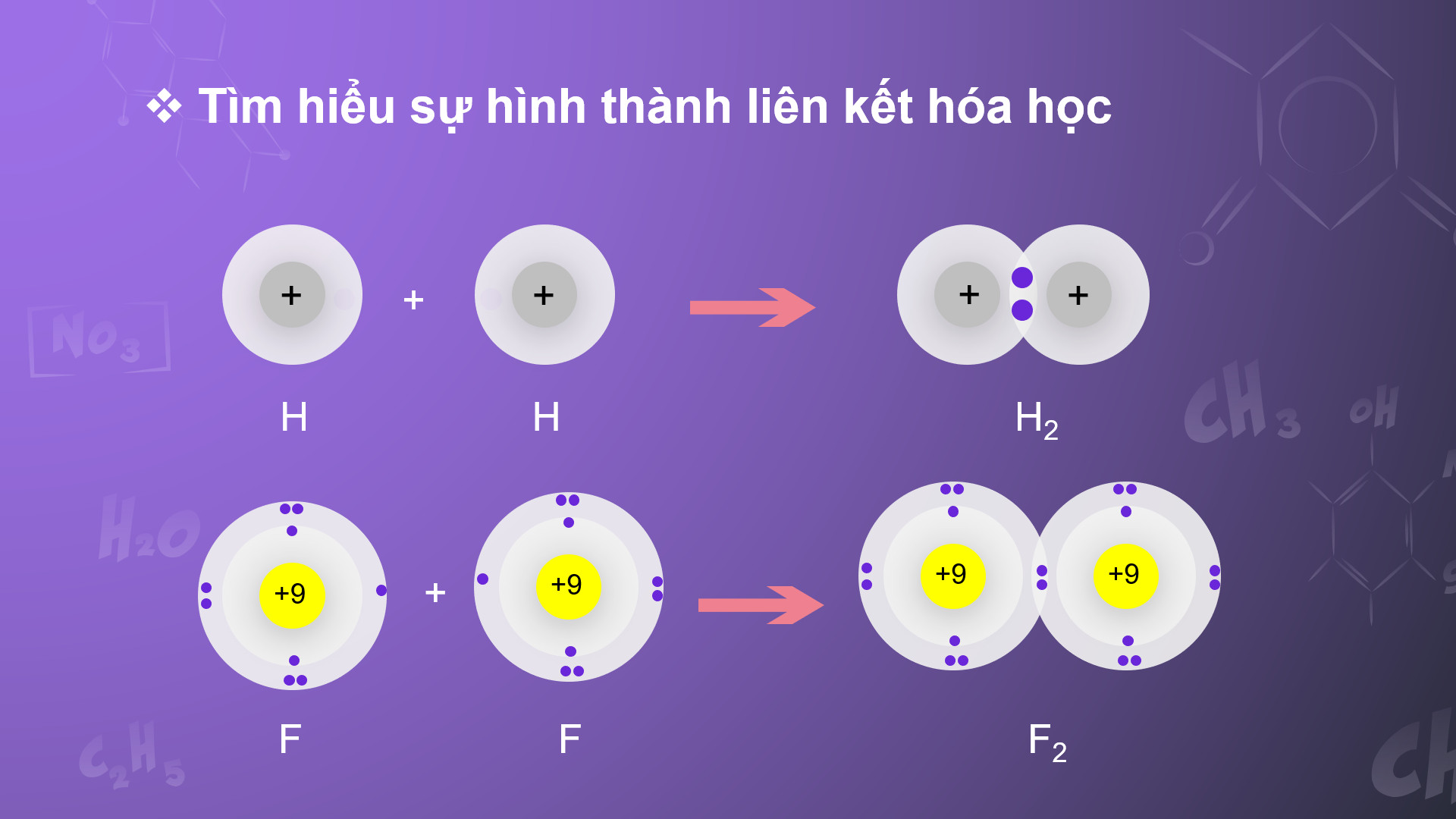
+ Vận dụng được quy tắc octet trong quá trình hình thành liên kết hoá học cho các nguyên tố nhóm A. (5)
Phẩm chất
– Trung thực: Thật thà, ngay thẳng trong kết quả làm việc nhóm. (6)
– Trách nhiệm: Có tinh thần trách nhiệm cao để hoàn thành tốt nhiệm vụ được phân công. (7)
Thiết bị dạy học và học liệu
Giáo viên:
– Kế hoạch dạy học.
– Bài giảng powerpoint.
Học sinh:
– Sách giáo khoa.
– Đọc trước bài ở nhà.
III. TIẾN TRÌNH DẠY HỌC
Hoạt động 1: Mở đầu
|
Hoạt động 1: Mở đầu |
||||
|
a. Mục tiêu – Kích thích hứng thú, tạo tư thế sẵn sàng học tập và tiếp cận nội dung bài học. b. Nội dung – Nêu vấn đề và dẫn dắt vào nội dung bài học. c. Sản phẩm – Helium là nguyên tử khí hiếm có cấu hình bền vững. d. Tổ chức hoạt động học
|
Hoạt động 2: Hình thành kiến thức
|
Hoạt động 2.1. Khái niệm liên kết hóa học |
|||||
|
a. Mục tiêu – HS trình bày được khái niệm liên kết hóa học. b. Nội dung – Sử dụng phương pháp đàm thoại gợi mở và thảo luận nhóm đôi để tìm hiểu về khái niệm liên kết hóa học. c. Sản phẩm
d. Tổ chức hoạt động học
|
|
Hoạt động 2.2. Quy tắc octet |
|||||
|
a. Mục tiêu – HS trình bày được quy tắc octet với các nguyên tố nhóm A. b. Nội dung – Sử dụng phương pháp đàm thoại gợi mở để tìm hiểu về quy tắc octet với các nguyên tố nhóm A. c. Sản phẩm
d. Tổ chức hoạt động học
|
|
Hoạt động 2.2. Vận dụng quy tắc octet trong quá trình hình thành liên kết hóa học của các nguyên tố nhóm A |
|||||
|
a. Mục tiêu – Vận dụng được quy tắc octet trong quá trình hình thành liên kết hoá học cho các nguyên tố nhóm A. (5) b. Nội dung – Thảo luận nhóm vận dụng quy tắc octet trong quá trình hình thành liên kết hóa học của các nguyên tố nhóm A. c. Sản phẩm
d. Tổ chức hoạt động học
|
Hoạt động 3: Luyện tập
|
Hoạt động 3: Luyện tập |
|||||
|
a. Mục tiêu – Ôn luyện những kiến thức đã học. b. Nội dung – Vận dụng kiến thức đã học để làm bài tập. c. Sản phẩm
d. Tổ chức hoạt động học
|
Hoạt động 4: Tổng kết
|
Hoạt động 4: Tổng kết |
|||||
|
a. Mục tiêu – Củng cố kiến thức (nhấn mạnh các kiến thức cần lưu ý) phần quy tắc octet trong quá trình hình thành liên kết hoá học cho các nguyên tố nhóm A. b. Nội dung – GV củng cố lại kiến thức. c. Sản phẩm
d. Tổ chức hoạt động học
|
Hoạt động 5: Giao nhiệm vụ về nhà.
|
Hoạt động 5: Giao nhiệm vụ về nhà. |
||||
|
a. Mục tiêu – Nhận xét kết quả học tập và nhắc nhở HS khắc phục. – Hướng dẫn tự rèn luyện và tìm tài liệu liên quan đến nội dung của bài học. b. Nội dung – Đọc và tìn hiểu bài: “LIÊN KẾT ION” c. Tổ chức hoạt động học
|
PHỤ LỤC
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..